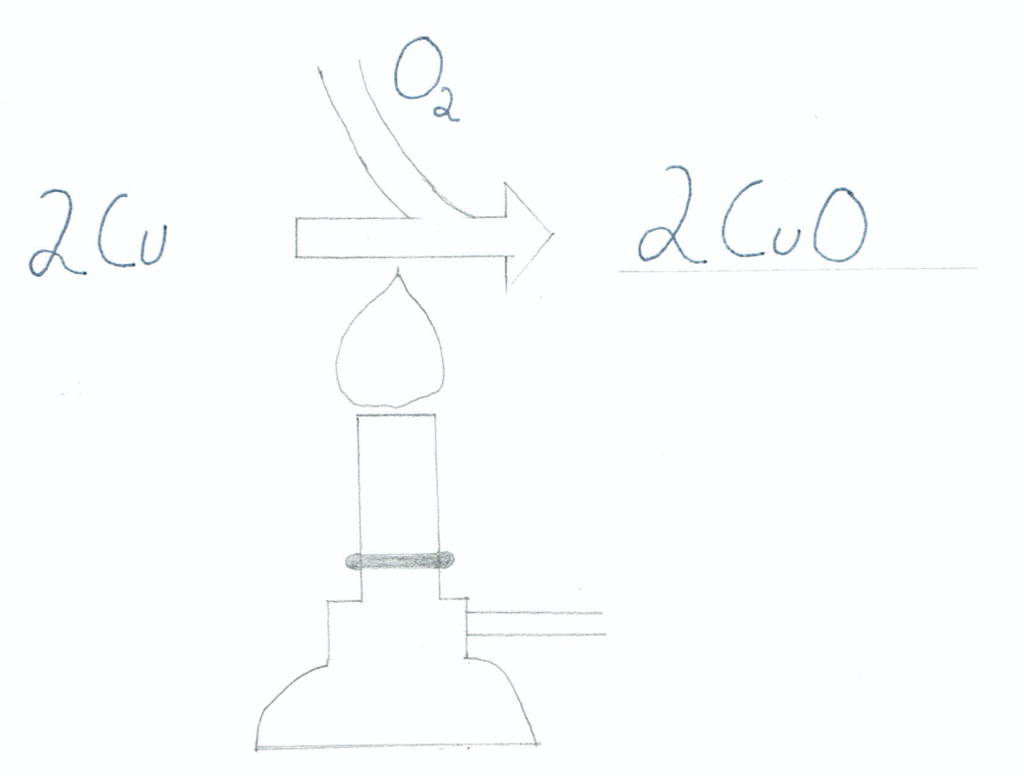
Die Brennerflamme liefert die Aktivierungsenergie, welche eine Reaktion (hier: Redoxreaktion) ermöglicht. Die Metallspäne reagieren mit den Sauerstoffteilchen (O2) aus der Luft. Diese Reaktion bezeichnet sich als Redoxreaktion, da es sich hier um eine chemische Reaktion mit Sauerstoff handelt, bei der Elektronen übertragen werden. Sauerstoff in einer Redoxreaktion ist das Element, welches Elektronen aufnimmt. Die Flammenfarbe zeigt, wie edel oder unedel ein Element ist. Je weißer die Flamme, desto höher ist die Sauerstoffaffinität und desto unedler ist das Element.
Was sind Farben und wie entstehen diese ?
Genau genommen ist alles farblos, denn Gegenstände unterscheiden sich, indem sie unterschiedliche Wellenlängen des Lichts absorbieren bzw. reflektieren. Dies bedeutet, das die Summe aller im Licht der Sonne vorhandenen Wellenlängen sich zu dem Eindruck von weißem Licht mischen. Die verschiedenen Gegenstände/Materialien absorbieren und reflektieren unterschiedliche Wellenlängen, weshalb wir mehrere Farben wahrnehmen.
Eine Farbe ist ein Sinneseindruck, welcher durchs Licht vermittelt wird. Unser Auge ermöglicht es uns, die verschiedenen Wellenlängen wahrzunehmen. Genaugenommen sind es nicht Wellenlängen, sondern elektromagnetische Strahlungen, die man wahrnimmt.
Weshalb glühen die Metallspäne?
Die Metallspäne fangen an zu glühen, da sie sich in der Brennerflamme sehr schnell erhitzen.
Worterklärungen:
Affinität: Neigung von Atomen oder Atomgruppen, sich miteinander zu vereinigen bzw. sich umzusetzen.
Elektronen: Ladungsteilchen eines Atoms
